
- 脊椎脊髄グループ・機能神経外科グループのメンバーで構成されている当グループは、げっ歯類やサルに対して様々な細胞移植を定位的手術(stereotactic surgery)で行い、再生医療の研究を行う研究グループです。その略称としていつしか“移植ステレオグループ”と名前が定着しました。先代教授の伊達勲先生はじめ、多くの先生方が世界的に評価の高い研究雑誌に論文を発表してきました。近年では再生医療にとどまらず、電気刺激装置や光遺伝学・生体内イメージング技術などを用いて、中枢神経疾患の病態・ニューロモデュレーション治療の効果・機序の解明、新たなる治療法開発を目指して研究を行っています。
- 我々、移植ステレオグループの研究のモチベーションは、臨床で経験した、患者さんを助けることができなかった苦い経験です。今現在は助けることができない患者さんへ新たな治療法を届けるべく、立ち止まることなく前進して参ります。
- 現在進行中のプロジェクトの詳細は、掲載しておりません。ですが、我々のHPをみて興味を頂いた方はいつでもご連絡下さい。Web meetingもしくはon siteでの見学をスケジュールいたします。学生の方々も大歓迎です。
- 連絡先: 金恭平 kkin0301○okayama-u.ac.jp(○→ @へご変更ください)
新着情報
- 2025年4月
永瀬喬之先生の論文がExperimental Neurologyに掲載されました。
Therapeutic effects of intracerebral transplantation of human modified bone marrow-derived stromal cells (SB623) with voluntary and forced exercise in a rat model of ischemic stroke - 2025年3月
菅原千明先生の論文がBrain Researchに掲載されました。
Repeated non-hemorrhagic and non-contusional mild traumatic brain injury in rats elicits behavioral impairment with microglial activation, astrogliosis, and tauopathy: Reproducible and quantitative model of chronic traumatic encephalopathy
- 2024年6月
岡崎洋介先生の論文がScientific Reportsに掲載されました。
Cervical spinal cord stimulation exerts anti-epileptic effects in a rat model of epileptic seizure through the suppression of CCL2-mediated cascades
研究の特徴
研究テーマ
脳梗塞、パーキンソン病、頭部外傷の3つの疾患を標的に研究を行っています。
➀脳梗塞
近年の医療技術の進歩により、脳梗塞の超急性期治療は飛躍的に向上しました。しかし、その後に後遺症が残った患者さんに対する有効な治療法は、ここ数十年で大きな進展がありません。私たちは、再生医療や運動療法を活用し、脳梗塞治療の新たなブレイクスルーとなる治療法の開発を目指しています。
➁パーキンソン病
パーキンソン病に対しては、薬物療法や脳深部刺激療法(Deep Brain Stimulation)をはじめとするデバイス補助療法の進歩により、症状の制御が可能となってきました。しかし、私たち脳神経外科医が日々直面しているのは、これらの治療法では十分に症状をコントロールできない患者さんの存在です。
ふるえ(静止時振戦)、筋肉のこわばり(筋強剛)、動作の遅れや減少(動作緩慢・無動)などの運動症状に加え、パーキンソン病は多様な非運動症状も伴います。その病態生理は、現在もなお十分には解明されていません。
私たちは、最先端の神経科学技術を駆使し、基礎研究と臨床研究の両面から病態の解明と新規治療法の開発に取り組んでいます。
➂頭部外傷
頭部外傷は脳神経外科および救急医療の分野で最も一般的な疾患の一つです。頭部外傷の手術は、若手脳神経外科医にとって登竜門であり、ベテラン医師でも予測が難しい奥深い手術です。
しかし、救命後の患者さんの機能改善につながる治療法は、リハビリテーションを除いて未だ確立されていません。また、モデル動物作成の煩雑さから、研究対象としても十分に注目されてこなかった分野です。
そこで私たちは、救命救急科と連携し、臨床現場さながらの頭部外傷モデルラットを確立しました。今後、このモデルラットを活用した企業との共同研究も予定しています。
Material & Methods
移植ステレオグループの研究で現在用いている技術を紹介します。
➀ラット用電気刺激装置
 私たちは、ユニークメディカル社特製のラット用電気刺激装置を用いた先進的な研究を展開しています。この装置は24時間連続での電気刺激が可能で、細部にわたる刺激パラメータを精密に設定できる特長を持っています。これにより、迷走神経刺激療法、脊髄刺激療法、脳深部刺激療法など、臨床で実施される様々な電気刺激療法をラットモデルで高精度に再現することが可能となり、基礎研究と臨床応用の橋渡しを実現しています。
私たちは、ユニークメディカル社特製のラット用電気刺激装置を用いた先進的な研究を展開しています。この装置は24時間連続での電気刺激が可能で、細部にわたる刺激パラメータを精密に設定できる特長を持っています。これにより、迷走神経刺激療法、脊髄刺激療法、脳深部刺激療法など、臨床で実施される様々な電気刺激療法をラットモデルで高精度に再現することが可能となり、基礎研究と臨床応用の橋渡しを実現しています。
➁光遺伝学
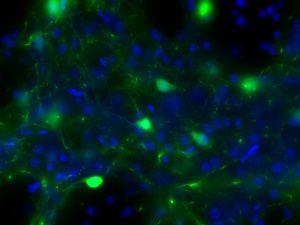 光遺伝学は、オプシンと呼ばれる光駆動性イオンチャネル(ポンプ)を活用して神経活動を精密に制御する革新的手法です。ウイルスベクターを用いて標的となる神経細胞にオプシンを発現させると、その細胞は特定波長の光に反応して選択的に活性化(または抑制)されます。この技術により、これまで困難だった特定神経回路の機能解析が可能となり、脳機能の理解や神経疾患の病態解明に新たな視点をもたらします。
光遺伝学は、オプシンと呼ばれる光駆動性イオンチャネル(ポンプ)を活用して神経活動を精密に制御する革新的手法です。ウイルスベクターを用いて標的となる神経細胞にオプシンを発現させると、その細胞は特定波長の光に反応して選択的に活性化(または抑制)されます。この技術により、これまで困難だった特定神経回路の機能解析が可能となり、脳機能の理解や神経疾患の病態解明に新たな視点をもたらします。
➂生体内カルシウムイメージ
 高性能な微小レンズをラットの脳内に精密に埋め込むことで、生きた状態での神経細胞活動を単一細胞レベルでリアルタイムに可視化・計測しています。自由に行動するラットの脳内神経活動をダイナミックに捉えることで、従来の固定組織観察では得られなかった貴重な知見を獲得できます。この先端イメージング技術は、神経回路の動作原理や疾患時の異常活動パターンの解明に重要な手がかりを提供します。
高性能な微小レンズをラットの脳内に精密に埋め込むことで、生きた状態での神経細胞活動を単一細胞レベルでリアルタイムに可視化・計測しています。自由に行動するラットの脳内神経活動をダイナミックに捉えることで、従来の固定組織観察では得られなかった貴重な知見を獲得できます。この先端イメージング技術は、神経回路の動作原理や疾患時の異常活動パターンの解明に重要な手がかりを提供します。
➃間葉系幹細胞
間葉系幹細胞の脳内移植は様々な中枢神経疾患への有効性が報告され、ヒトでの臨床試験も複数行われています。しかし、臨床応用には至っていないのが実情です。一方、サブ解析では有用性を示唆する臨床データも存在します。これらの知見は、間葉系幹細胞はどのような患者にもで有効なわけではないが、有効な患者が存在する、ということです。私たちは、間葉系幹細胞治療の臨床応用を加速させるための科学的エビデンスの創出を目指し、効果予測バイオマーカーの同定や移植技術の最適化に取り組んでいます。
競争的獲得資金獲得状況
日本学術振興会 科学研究費助成事業
| 研究代表者 | |
|---|---|
| 若手研究 | 金 恭平 |
研究助成金
| 研究代表者 | ||
|---|---|---|
| 2021年度 | 医療法人万成病院小林孫兵衛記念医学振興財団 第30回研究助成 | 佐々木 達也 |
| 2023年度 | 公益財団法人 寺岡記念育英会 研究活動費助成事業 | 金 恭平 |
| 公益財団法人両備 園記念財団 2023年度(第45回)研究助成 | 金 恭平 | |
| 公益財団法人 住友財団 2023年度基礎科学研究助成 | 金 恭平 | |
| 第23回 公益財団法人 岡山医学振興会 公募助成 | 金 恭平 | |
| 2024年度 | 公益財団法人 てんかん治療研究振興財団 研究助成 | 佐々木 達也 |
| 公益財団法人 医学教育振興財団 医学教育研究助成 | 金 恭平 | |
| 公益財団法人 山陽放送学術文化・スポーツ振興財団 学術研究助成 | 金 恭平 | |
| 公益財団法人 川崎医学・医療福祉学振興会 教育研究助成 | 金 恭平 | |
| 特定医療法人 万成病院小林孫兵衛記念医学振興財団 研究助成 | 金 恭平 | |
| 公益財団法人 上原記念生命科学財団 研究奨励金 | 金 恭平 | |
| 2024–27年度 | 公益財団法人 武田科学振興財団 ビジョナリーリサーチ助成(スタート) | 金 恭平 |
| 2025年度 | 公益財団法人 UBE学術振興財団 学術奨励賞 | 金 恭平 |
| 公益財団法人 大樹生命厚生財団 医学研究助成 | 金 恭平 |
研究論文
2025
- Nagase T, Yasuhara T, Kin K, Sasada S, Kawauchi S, Yabuno S, Sugahara C, Hirata Y, Miyake H, Sasaki T, Kawai K, Tanimoto S, Saijo T, Tanaka S. Therapeutic effects of intracerebral transplantation of human modified bone marrow-derived stromal cells (SB623) with voluntary and forced exercise in a rat model of ischemic stroke. Experimental Neurology 2025 Apr:386:115145. doi: 10.1016/j.expneurol.2025.115145
- Sugahara C, Kin K, Sasaki T, Sasada S, Kawauchi S, Yabuno S, Nagase T, Hirayama T, Masai K, Hosomoto K, Okazaki Y, Kawai K, Tanimoto S, Hirata Y, Miyake H, Naito H, Yasuhara T, Borlongan CV, Date I, Tanaka S. Repeated non-hemorrhagic and non-contusional mild traumatic brain injury in rats elicits behavioral impairment with microglial activation, astrogliosis, and tauopathy: Reproducible and quantitative model of chronic traumatic encephalopathy. Brain Research 2025 Mar 1:1850:149412. doi:10.1016/j.brainres.2024.149412
2024
- Okazaki Y, Sasaki T, Hosomoto K, Tanimoto S, Kawai K, Nagase T, Sugahara C, Yabuno S, Kin K, Sasada S, Yasuhara T, Tanaka S, Date I. Cervical spinal cord stimulation exerts anti-epileptic effects in a rat model of epileptic seizure through the suppression of CCL2-mediated cascades. Scientific Reports 2024 Jun 24;14(1):14543. doi:10.1038/s41598-024-64972-y
2023
- Hosomoto K, Sasaki T, Yasuhara T, Kameda M, Sasada S, Kin I, Kuwahara K, Kawauchi S, Okazaki Y, Yabuno S, Sugahara C, Kawai K, Nagase T, Tanimoto S, Borlongan CV, Date I. Continuous vagus nerve stimulation exerts beneficial effects on rats with experimentally induced Parkinson’s disease: Evidence suggesting involvement of a vagal afferent pathway. Brain Stimul. 2023 Mar-Apr;16(2):594-603. doi: 10.1016/j.brs.2023.03.003. Epub 2023 Mar 12. PMID: 36914065.
- Yabuno S, Yasuhara T, Nagase T, Kawauchi S, Sugahara C, Okazaki Y, Hosomoto K, Sasada S, Sasaki T, Tajiri N, Borlongan CV, Date I. Synergistic therapeutic effects of intracerebral transplantation of human modified bone marrow-derived stromal cells (SB623) and voluntary exercise with running wheel in a rat model of ischemic stroke. Stem Cell Res Ther. 2023 Jan 24;14(1):10. doi: 10.1186/s13287-023-03236-4. Erratum in: Stem Cell Res Ther. 2023 May 8;14(1):123. PMID: 36691091; PMCID: PMC9872315.
2022
- Kawauchi S, Yasuhara T, Kin K, Yabuno S, Sugahara C, Nagase T, Hosomoto K, Okazaki Y, Tomita Y, Umakoshi M, Sasaki T, Kameda M, Borlongan CV, Date I. Transplantation of modified human bone marrow-derived stromal cells affords therapeutic effects on cerebral ischemia in rats. CNS Neurosci Ther. 2022 Dec;28(12):1974-1985. doi: 10.1111/cns.13947. Epub 2022 Aug 24. PMID: 36000240; PMCID: PMC9627357.
- Tomita Y, Kameda M, Senoo T, Tokuyama E, Sugahara C, Yabuno S, Okazaki Y, Kawauchi S, Hosomoto K, Sasaki T, Yasuhara T, Date I. Growth Curves for Intracranial Volume and Two-dimensional Parameters for Japanese Children without Cranial Abnormality: Toward Treatment of Craniosynostosis. Neurol Med Chir (Tokyo). 2022 Feb 15;62(2):89-96. doi: 10.2176/nmc.oa.2021-0208. Epub 2021 Nov 12. PMID: 34776463; PMCID: PMC8841234.
2021
- Umakoshi M, Yasuhara T, Morimoto J, Murai S, Sasaki T, Kameda M, Kin K, Miyoshi Y, Date I. Spinal Surgery after Bilateral Subthalamic Stimulation for Patients with Parkinson’s Disease: A Retrospective Outcome Analysis of Pain and Functional Control. Neurol Med Chir (Tokyo). 2021;61(10):607-618. doi:10.2176/nmc.oa.2021-0094
- Kin I, Sasaki T, Yasuhara T, Kameda M, Agari T, Okazaki M, Hosomoto K, Okazaki Y, Yabuno S, Kawauchi S, Kuwahara K, Morimoto J, Kin K, Umakoshi M, Tomita Y, Tajiri N, Borlongan CV, Date I. Vagus Nerve Stimulation with Mild Stimulation Intensity Exerts Anti-Inflammatory and Neuroprotective Effects in Parkinson’s Disease Model Rats. Biomedicines. 2021;9(7):789. Published 2021 Jul 7. doi:10.3390/biomedicines9070789
2020
- Kuwahara K, Sasaki T, Yasuhara T, Kameda M, Okazaki Y, Hosomoto K, Kin I, Okazaki M, Yabuno S, Kawauchi S, Tomita Y, Umakoshi M, Kin K, Morimoto J, Lee JY, Tajiri N, Borlongan CV, Date I. Long-Term Continuous Cervical Spinal Cord Stimulation Exerts Neuroprotective Effects in Experimental Parkinson’s Disease. Front Aging Neurosci. 2020 Jun 16;12:164. doi: 10.3389/fnagi.2020.00164. PMID: 32612523; PMCID: PMC7309445.
- Kin K, Yasuhara T, Kameda M, Tomita Y, Umakoshi M, Kuwahara K, Kin I, Kidani N, Morimoto J, Okazaki M, Sasaki T, Tajiri N, Borlongan CV, Date I. Cell encapsulation enhances antidepressant effect of the mesenchymal stem cells and counteracts depressive-like behavior of treatment-resistant depressed rats. Mol Psychiatry. 2020 Jun;25(6):1202-1214. doi: 10.1038/s41380-018-0208-0. Epub 2018 Aug 14. PMID: 30108315.
2018
- Okazaki M, Sasaki T, Yasuhara T, Kameda M, Agari T, Kin I, Kuwahara K, Morimoto J, Kin K, Umakoshi M, Tomita Y, Borlongan CV, Date I. Characteristics and prognostic factors of Parkinson’s disease patients with abnormal postures subjected to subthalamic nucleus deep brain stimulation. Parkinsonism Relat Disord. 2018 Dec;57:44-49. doi: 10.1016/j.parkreldis.2018.07.014. Epub 2018 Jul 25. PMID: 30082148.
- Morimoto J, Yasuhara T, Kameda M, Umakoshi M, Kin I, Kuwahara K, Kin K, Okazaki M, Takeuchi H, Sasaki T, Toyoshima A, Tajiri N, Agari T, Borlongan CV, Date I. Electrical Stimulation Enhances Migratory Ability of Transplanted Bone Marrow Stromal Cells in a Rodent Ischemic Stroke Model. Cell Physiol Biochem. 2018;46(1):57-68. doi: 10.1159/000488409. Epub 2018 Mar 20. PMID: 29587284.
- Takeuchi H, Kameda M, Yasuhara T, Sasaki T, Toyoshima A, Morimoto J, Kin K, Okazaki M, Umakoshi M, Kin I, Kuwahara K, Tomita Y, Date I. Long-Term Potentiation Enhances Neuronal Differentiation in the Chronic Hypoperfusion Model of Rats. Front Aging Neurosci. 2018 Feb 15;10:29. doi: 10.3389/fnagi.2018.00029. PMID: 29527162; PMCID: PMC5829584.
2017
- Sasada S, Agari T, Sasaki T, Kondo A, Shinko A, Wakamori T, Okazaki M, Kin I, Kuwahara K, Kameda M, Yasuhara T, Date I. Efficacy of Fiber Tractography in the Stereotactic Surgery of the Thalamus for Patients with Essential Tremor. Neurol Med Chir (Tokyo). 2017 Aug 15;57(8):392-401. doi: 10.2176/nmc.oa.2016-0277. Epub 2017 May 1. PMID: 28458383; PMCID: PMC5566698.
2016
- Sasaki T, Liu K, Agari T, Yasuhara T, Morimoto J, Okazaki M, Takeuchi H, Toyoshima A, Sasada S, Shinko A, Kondo A, Kameda M, Miyazaki I, Asanuma M, Borlongan CV, Nishibori M, Date I. Anti-high mobility group box 1 antibody exerts neuroprotection in a rat model of Parkinson’s disease. Exp Neurol. 2016 Jan;275 Pt 1:220-31. doi: 10.1016/j.expneurol.2015.11.003. Epub 2015 Nov 10. PMID: 26555088.
2015
- Toyoshima A, Yasuhara T, Kameda M, Morimoto J, Takeuchi H, Wang F, Sasaki T, Sasada S, Shinko A, Wakamori T, Okazaki M, Kondo A, Agari T, Borlongan CV, Date I. Intra-Arterial Transplantation of Allogeneic Mesenchymal Stem Cells Mounts Neuroprotective Effects in a Transient Ischemic Stroke Model in Rats: Analyses of Therapeutic Time Window and Its Mechanisms. PLoS One. 2015 Jun 15;10(6):e0127302. doi: 10.1371/journal.pone.0127302. PMID: 26075717; PMCID: PMC4468176.
2014
- Shinko A, Agari T, Kameda M, Yasuhara T, Kondo A, Tayra JT, Sato K, Sasaki T, Sasada S, Takeuchi H, Wakamori T, Borlongan CV, Date I. Spinal cord stimulation exerts neuroprotective effects against experimental Parkinson’s disease. PLoS One. 2014 Jul 10;9(7):e101468. doi: 10.1371/journal.pone.0101468. PMID: 25009993; PMCID: PMC4092020.
- Wakamori T, Agari T, Yasuhara T, Kameda M, Kondo A, Shinko A, Sasada S, Sasaki T, Furuta T, Date I. Cognitive functions in Parkinson’s disease: relation to disease severity and hallucination. Parkinsonism Relat Disord. 2014 Apr;20(4):415-20. doi: 10.1016/j.parkreldis.2014.01.002. Epub 2014 Jan 13. PMID: 24467818.
2013
- Thomas Tayra J, Kameda M, Yasuhara T, Agari T, Kadota T, Wang F, Kikuchi Y, Liang H, Shinko A, Wakamori T, Vcelar B, Weik R, Date I. The neuroprotective and neurorescue effects of carbamylated erythropoietin Fc fusion protein (CEPO-Fc) in a rat model of Parkinson’s disease. Brain Res. 2013 Mar 28;1502:55-70. doi: 10.1016/j.brainres.2013.01.042. Epub 2013 Feb 1. PMID: 23380533.
2011
- Kikuchi Y, Yasuhara T, Agari T, Kondo A, Kuramoto S, Kameda M, Kadota T, Baba T, Tajiri N, Wang F, Tayra JT, Liang H, Miyoshi Y, Borlongan CV, Date I. Urinary 8-OHdG elevations in a partial lesion rat model of Parkinson’s disease correlate with behavioral symptoms and nigrostriatal dopaminergic depletion. J Cell Physiol. 2011 May;226(5):1390-8. doi: 10.1002/jcp.22467. PMID: 20945350.
2010
- Wang F, Yasuhara T, Shingo T, Kameda M, Tajiri N, Yuan WJ, Kondo A, Kadota T, Baba T, Tayra JT, Kikuchi Y, Miyoshi Y, Date I. Intravenous administration of mesenchymal stem cells exerts therapeutic effects on parkinsonian model of rats: focusing on neuroprotective effects of stromal cell-derived factor-1alpha. BMC Neurosci. 2010 Apr 26;11:52. doi: 10.1186/1471-2202-11-52. PMID: 20420688; PMCID: PMC2873592.
- Tajiri N, Yasuhara T, Shingo T, Kondo A, Yuan W, Kadota T, Wang F, Baba T, Tayra JT, Morimoto T, Jing M, Kikuchi Y, Kuramoto S, Agari T, Miyoshi Y, Fujino H, Obata F, Takeda I, Furuta T, Date I. Exercise exerts neuroprotective effects on Parkinson’s disease model of rats. Brain Res. 2010 Jan 15;1310:200-7. doi: 10.1016/j.brainres.2009.10.075. Epub 2009 Nov 10. PMID: 19900418.
2009
- Kuramoto S, Yasuhara T, Agari T, Kondo A, Matsui T, Miyoshi Y, Shingo T, Date I. Injection of muscimol, a GABAa agonist into the anterior thalamic nucleus, suppresses hippocampal neurogenesis in amygdala-kindled rats. Neurol Res. 2009 May;31(4):407-13. doi: 10.1179/174313208X346125. Epub 2008 Sep 29. PMID: 18826756.
- Kondo A, Shingo T, Yasuhara T, Kuramoto S, Kameda M, Kikuchi Y, Matsui T, Miyoshi Y, Agari T, Borlongan CV, Date I. Erythropoietin exerts anti-epileptic effects with the suppression of aberrant new cell formation in the dentate gyrus and upregulation of neuropeptide Y in seizure model of rats. Brain Res. 2009 Nov 3;1296:127-36. doi: 10.1016/j.brainres.2009.08.025. Epub 2009 Aug 18. PMID: 19695235.
- Kadota T, Shingo T, Yasuhara T, Tajiri N, Kondo A, Morimoto T, Yuan WJ, Wang F, Baba T, Tokunaga K, Miyoshi Y, Date I. Continuous intraventricular infusion of erythropoietin exerts neuroprotective/rescue effects upon Parkinson’s disease model of rats with enhanced neurogenesis. Brain Res. 2009 Feb 13;1254:120-7. doi: 10.1016/j.brainres.2008.11.094. Epub 2008 Dec 10. PMID: 19101524.
2008
- Yuan WJ, Yasuhara T, Shingo T, Muraoka K, Agari T, Kameda M, Uozumi T, Tajiri N, Morimoto T, Jing M, Baba T, Wang F, Leung H, Matsui T, Miyoshi Y, Date I. Neuroprotective effects of edaravone-administration on 6-OHDA-treated dopaminergic neurons. BMC Neurosci. 2008 Aug 1;9:75. doi: 10.1186/1471-2202-9-75. PMID: 18671880; PMCID: PMC2533664.
- Takahashi K, Yasuhara T, Shingo T, Muraoka K, Kameda M, Takeuchi A, Yano A, Kurozumi K, Agari T, Miyoshi Y, Kinugasa K, Date I. Embryonic neural stem cells transplanted in middle cerebral artery occlusion model of rats demonstrated potent therapeutic effects, compared to adult neural stem cells. Brain Res. 2008 Oct 9;1234:172-82. doi: 10.1016/j.brainres.2008.07.086. Epub 2008 Jul 30. PMID: 18703033.
- Agari T, Yasuhara T, Matsui T, Kuramoto S, Kondo A, Miyoshi Y, Shingo T, Borlongan CV, Date I. Intrapallidal metabotropic glutamate receptor activation in a rat model of Parkinson’s disease: behavioral and histological analyses. Brain Res. 2008 Apr 8;1203:189-96. doi: 10.1016/j.brainres.2008.01.051. Epub 2008 Jan 30. PMID: 18313647.
2007
- Kameda M, Shingo T, Takahashi K, Muraoka K, Kurozumi K, Yasuhara T, Maruo T, Tsuboi T, Uozumi T, Matsui T, Miyoshi Y, Hamada H, Date I. Adult neural stem and progenitor cells modified to secrete GDNF can protect, migrate and integrate after intracerebral transplantation in rats with transient forebrain ischemia. Eur J Neurosci. 2007 Sep;26(6):1462-78. doi: 10.1111/j.1460-9568.2007.05776.x. PMID: 17880388.
2006
- Kobayashi K, Yasuhara T, Agari T, Muraoka K, Kameda M, Ji Yuan W, Hayase H, Matsui T, Miyoshi Y, Shingo T, Date I. Control of dopamine-secretion by Tet-Off system in an in vivo model of parkinsonian rat. Brain Res. 2006 Aug 2;1102(1):1-11. doi: 10.1016/j.brainres.2006.04.078. Epub 2006 Jun 27. PMID: 16806124.
- Muraoka K, Shingo T, Yasuhara T, Kameda M, Yuan W, Hayase H, Matsui T, Miyoshi Y, Date I. The high integration and differentiation potential of autologous neural stem cell transplantation compared with allogeneic transplantation in adult rat hippocampus. Exp Neurol. 2006 Jun;199(2):311-27. doi: 10.1016/j.expneurol.2005.12.004. Epub 2006 Mar 9. PMID: 16529744.
2005
- Yano A, Shingo T, Takeuchi A, Yasuhara T, Kobayashi K, Takahashi K, Muraoka K, Matsui T, Miyoshi Y, Hamada H, Date I. Encapsulated vascular endothelial growth factor-secreting cell grafts have neuroprotective and angiogenic effects on focal cerebral ischemia. J Neurosurg. 2005 Jul;103(1):104-14. doi: 10.3171/jns.2005.103.1.0104. PMID: 16121981.
2004
- Yasuhara T, Shingo T, Kobayashi K, Takeuchi A, Yano A, Muraoka K, Matsui T, Miyoshi Y, Hamada H, Date I. Neuroprotective effects of vascular endothelial growth factor (VEGF) upon dopaminergic neurons in a rat model of Parkinson’s disease. Eur J Neurosci. 2004 Mar;19(6):1494-504. doi: 10.1111/j.1460-9568.2004.03254.x. PMID: 15066146.
2003
- Matsui T, Kita H. Activation of group III metabotropic glutamate receptors presynaptically reduces both GABAergic and glutamatergic transmission in the rat globus pallidus. Neuroscience. 2003;122(3):727-37. doi: 10.1016/j.neuroscience.2003.08.032. PMID: 14622916.
- Yoshida H, Date I, Shingo T, Fujiwara K, Kobayashi K, Miyoshi Y, Ohmoto T. Stereotactic transplantation of a dopamine-producing capsule into the striatum for treatment of Parkinson disease: a preclinical primate study. J Neurosurg. 2003 Apr;98(4):874-81. doi: 10.3171/jns.2003.98.4.0874. PMID: 12691415.
