- 臨床では不随意運動症(パーキンソン病など)に対する機能的定位脳手術、てんかんの外科手術を2本柱として行っています。
- 研究ではパーキンソン病、てんかんなどの慢性脳疾患の動物モデルに対して、ニューロモデュレーション治療を行い、新たな知見を発見しています。
- 全国でも有数の手術件数と、長年受け継がれてきた疾患に対する経験を基に患者さん毎に最適な治療を行います。
新着情報
- 2025年4月1日
泉原康平先生が大学院生で機能神経外科Gに入りました。
岡山大学脳神経外科機能神経外科グループのメンバー
※2025年4月現在
| 教授 | 田中 將太 | |
|---|---|---|
| 病棟医 | 佐々木 達也 | 助教:機能的定位脳手術、てんかん |
| 谷本 駿 | ||
| 研究室 | 西条 智也 | 大学院生 |
| 泉原 康平 | 大学院生 |
疾患の特徴と手術の内容
てんかん
- 乳幼児から高齢者まで罹患するありふれた疾患で、薬物治療が基本になります。
- 薬剤抵抗性てんかんとされるのは全体の2-3割です。
- 薬剤抵抗性てんかんのなかで「手術」が有効なケースがあります。
- 発作の根治を目指す「根治手術」と発作の頻度や程度を軽減させる「緩和手術」があります。
- 手術の有効性が最も高く、頻度が高いのは海馬硬化を有する側頭葉てんかんの手術です。
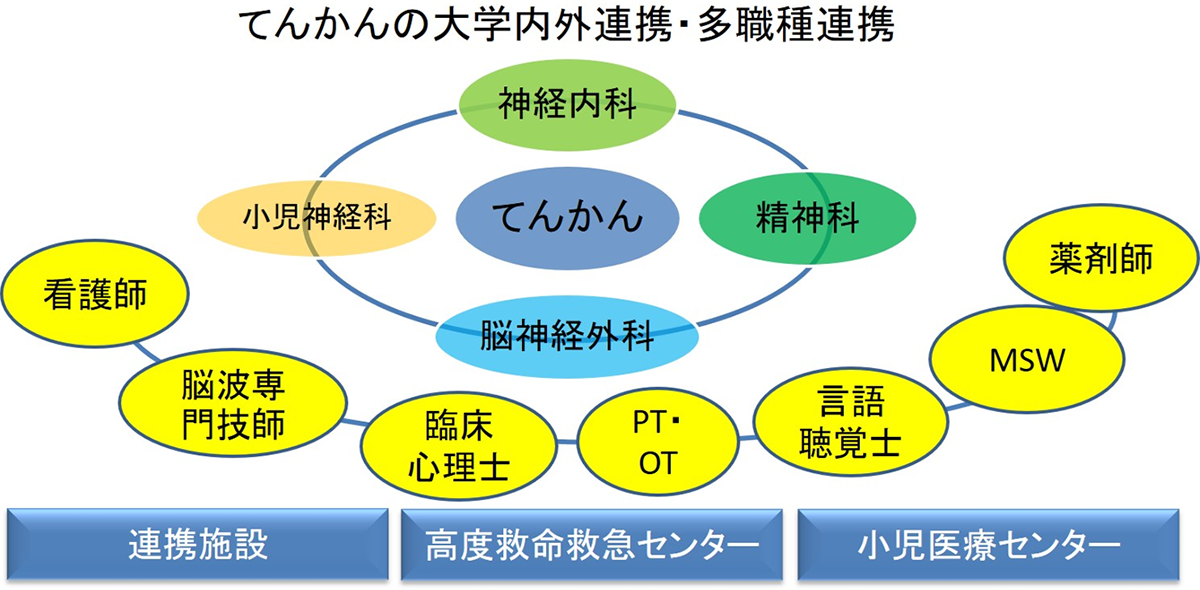
- 岡山大学はてんかんセンターを設置しており、小児神経科、脳神経内科、精神科と討議して、手術を決定します(当センターではすべてのてんかん手術に対応しています)。
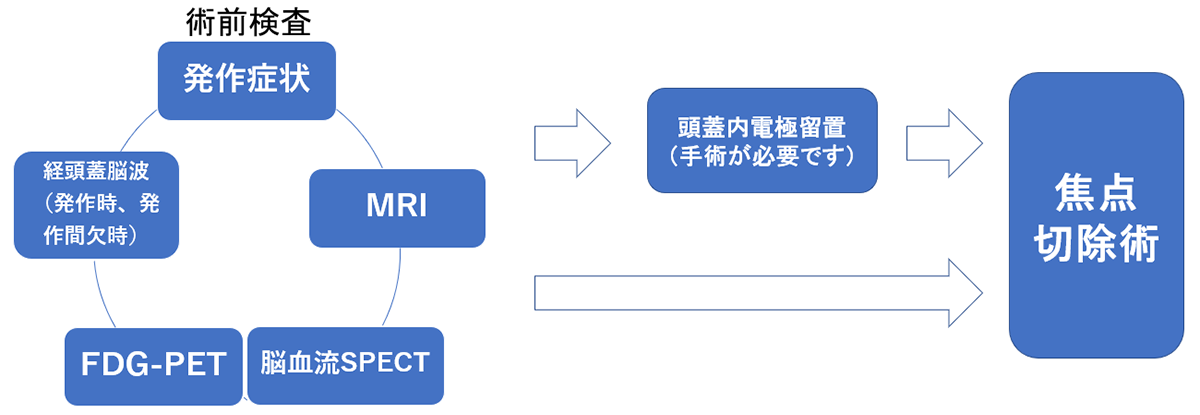
手術の流れ
多くの検査を行い、焦点を絞り込みます。
電極留置を経て切除術を行う場合(二期的手術)と、一期的に切除術を行う場合があります。
様々なてんかんの手術
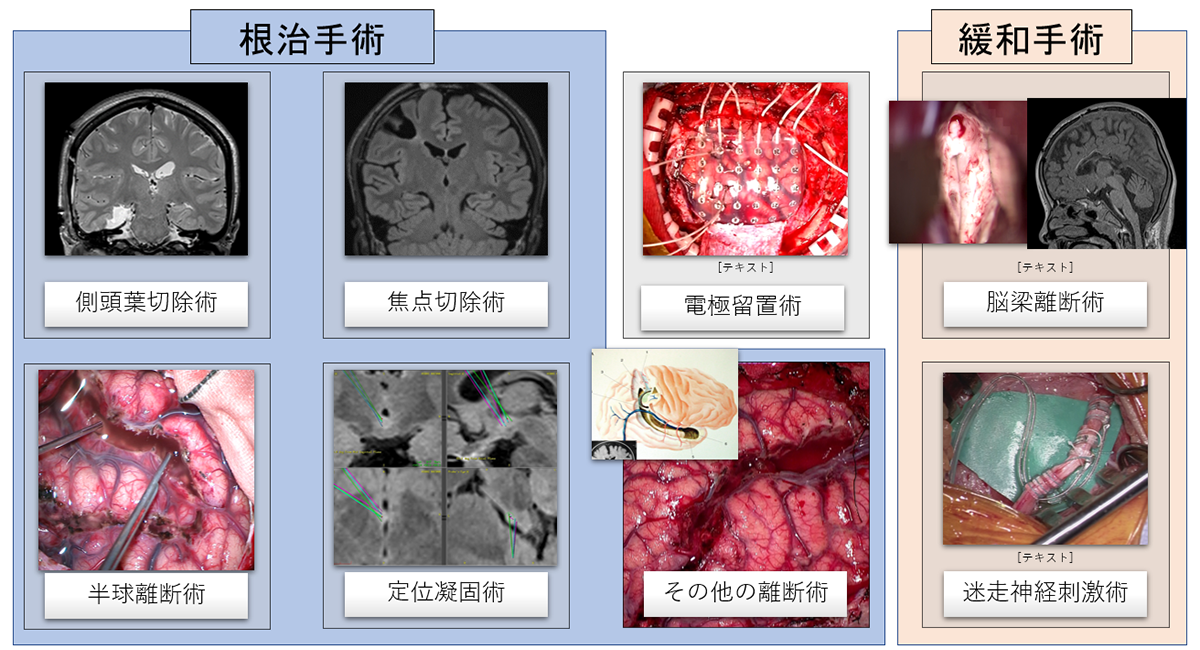
根治手術
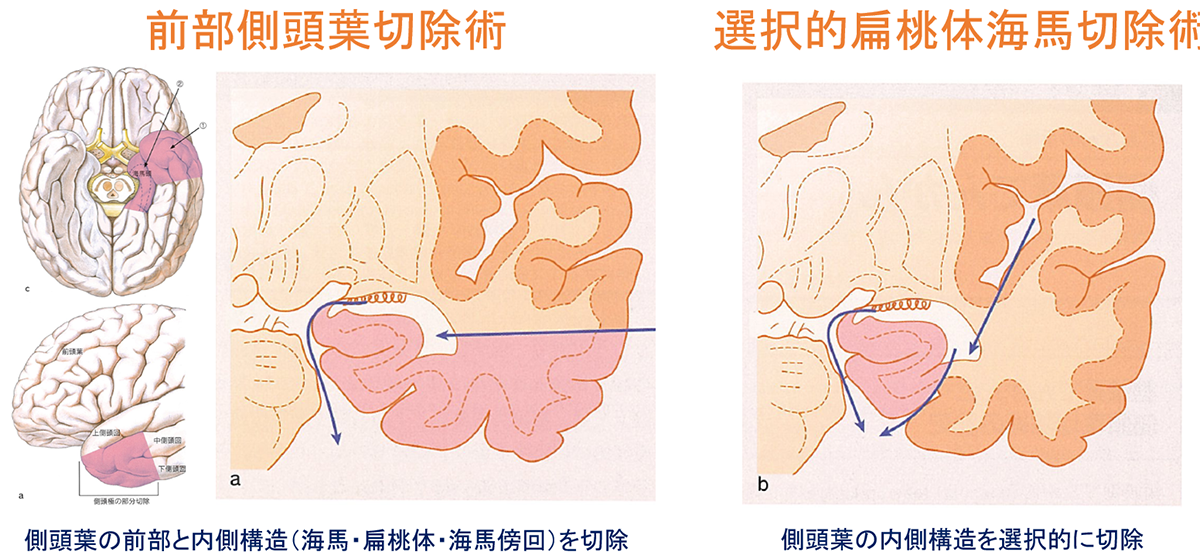
【側頭葉切除術】
てんかんの手術の最も代表的な手術です。
側頭葉てんかん(海馬硬化あり)に対する海馬切除術の発作抑制率は約80%です。
FLAIR画像で海馬の萎縮、高信号を認める場合には手術が奏功する可能性が十分あります。
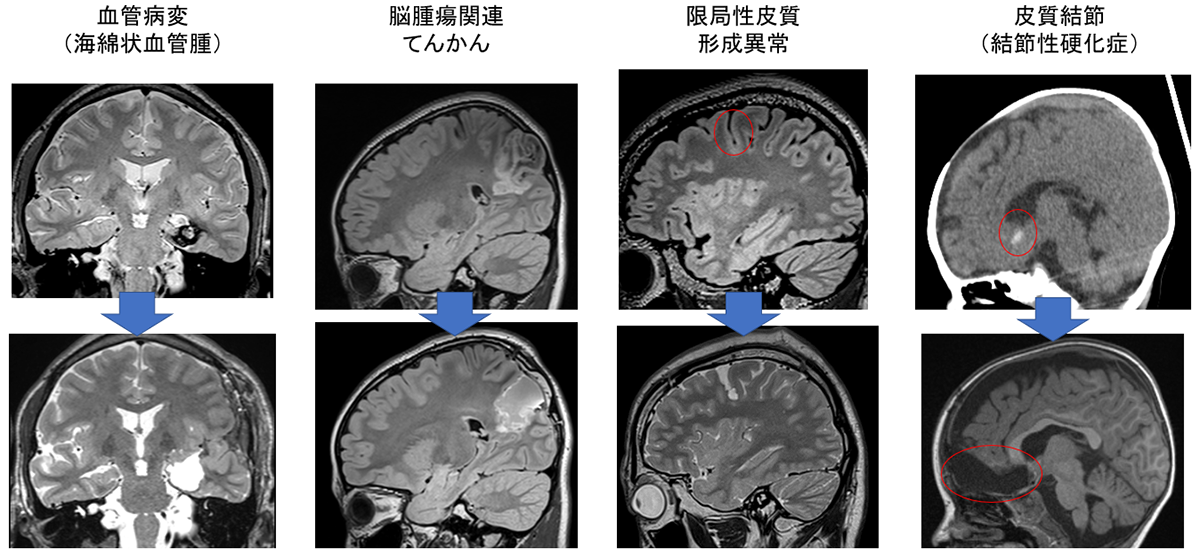
【焦点(病変)切除術】
原因は様々ですが、てんかんの焦点となる病変を切除します。
MRIで異常を認める場合には手術の奏効率が高くなります。
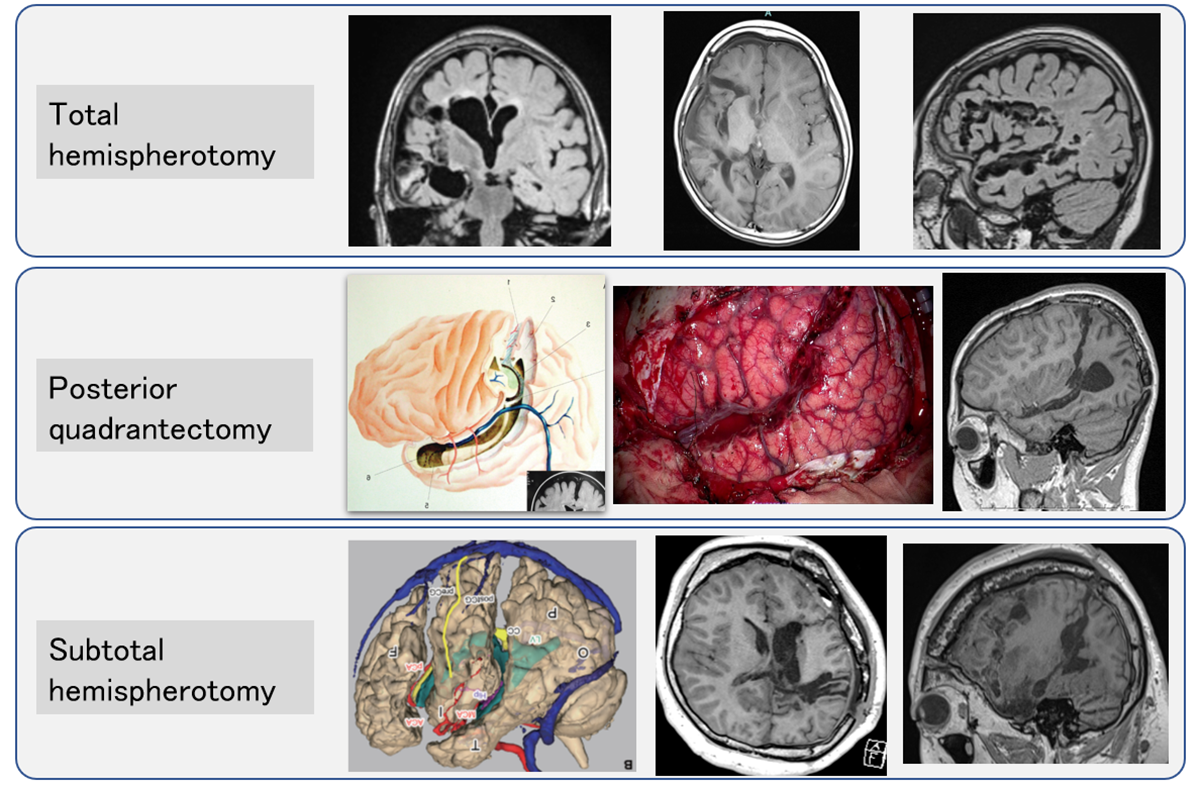
【離断術】
てんかん外科で行われる特殊な手術で、発作の伝播を遮断する手術です。
広範囲に異常を有するてんかんの場合に行われることがあります。
緩和手術
【脳梁離断術】
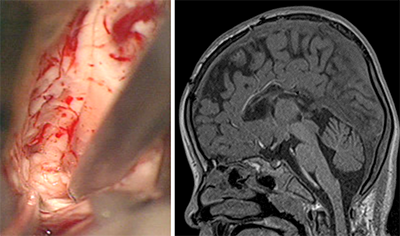 脳の真ん中にある脳梁を離断する手術です。
脳の真ん中にある脳梁を離断する手術です。
左右の脳の連絡を断ち、転倒する発作、強直発作、てんかん性スパズムなどに効果を有します。
【迷走神経刺激術】
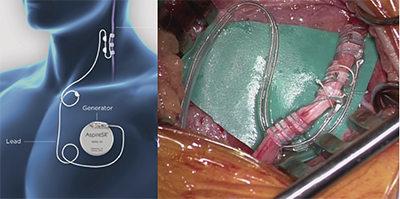 国内で唯一保険適応となっているデバイス治療です。
国内で唯一保険適応となっているデバイス治療です。
低侵襲で、約半数の患者さんの発作を半減します。
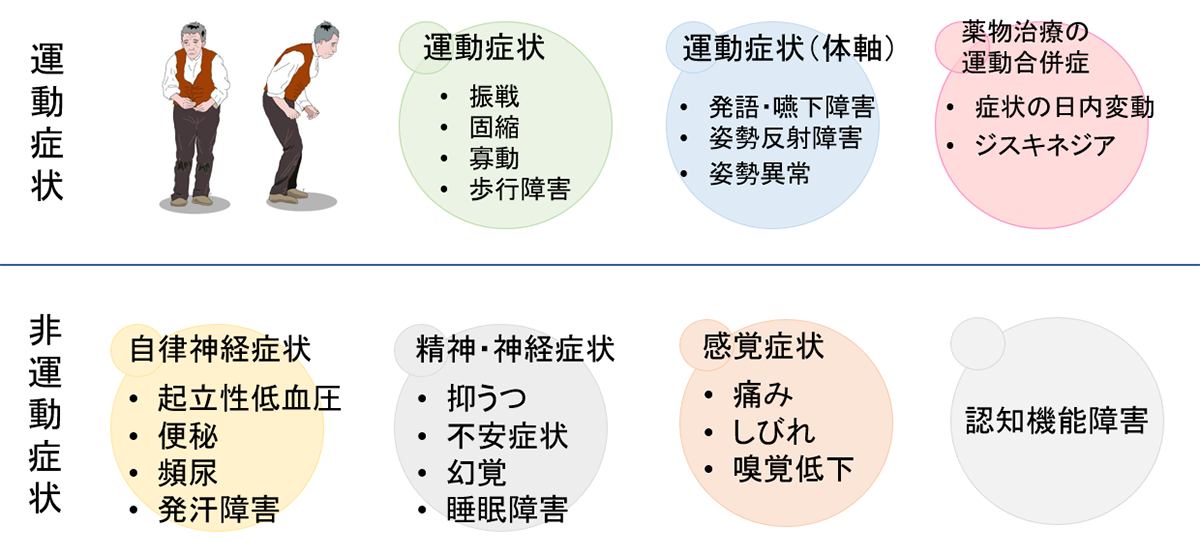
パーキンソン病・本態性振戦・ジストニア
パーキンソン病や本態性振戦などは不随意運動症と呼ばれ、薬剤抵抗性の場合手術で治療することができます。
治療は脳深部刺激療法(DBS)、ラジオ波凝固術(RF)、集束超音波治療(FUS)があります。
岡山大学ではFUS設備を有する岡山旭東病院と連携し、すべての治療を行うことが可能です。
患者さん毎に最適な治療方針を考え、提案します。
機能的定位脳手術の特徴
| 脳深部刺激療法(DBS) | ラジオ波凝固術(RF) | 集束超音波治療(FUS) | |
|---|---|---|---|
| 対象疾患 | パーキンソン病全般 不随意運動症全般 |
本態性振戦(片側) パーキンソン病(振るえが主症状) |
本態性振戦(片側) パーキンソン病(振るえが主症状 |
| 治療方法(原理) | 電気刺激 | ラジオ波による熱凝固 | 超音波による熱凝固 |
| 可逆か不可逆か | 可逆 | 不可逆 | 不可逆 |
| 調節性 | ◎ | できない | できない |
| 術後のフォローアップ | 定期的に必要 | 少ない | 少ない |
| 侵襲度 | 小さい(皮膚切開、穿頭が必要) | 小さい(皮膚切開、穿頭が必要) | 最小(皮膚切開が不要) |
| その他の利点 | 両側例に適している 全身麻酔も可能 |
出血のリスクがほぼない |
|
| その他 | DBS特有の機械トラブルの可能性 | 骨の密度が重要 全剃毛が必要 医療保険で一度しかできない |
脳深部刺激療法(Deep brain stimulation; DBS)
ラジオ波熱凝固術 (radiofrequency coagulation)
脳内のある標的に電極を留置し、高頻度刺激や熱凝固を行うことで、過活動となった標的を抑制し、臨床効果を得る。 
FUS治療
治療は起きたまま、MRI室で行います。皮膚切開は行いません。
最終的に50度後半の温度で凝固します。
治療中いつでもMRIを撮影できるのが利点です。
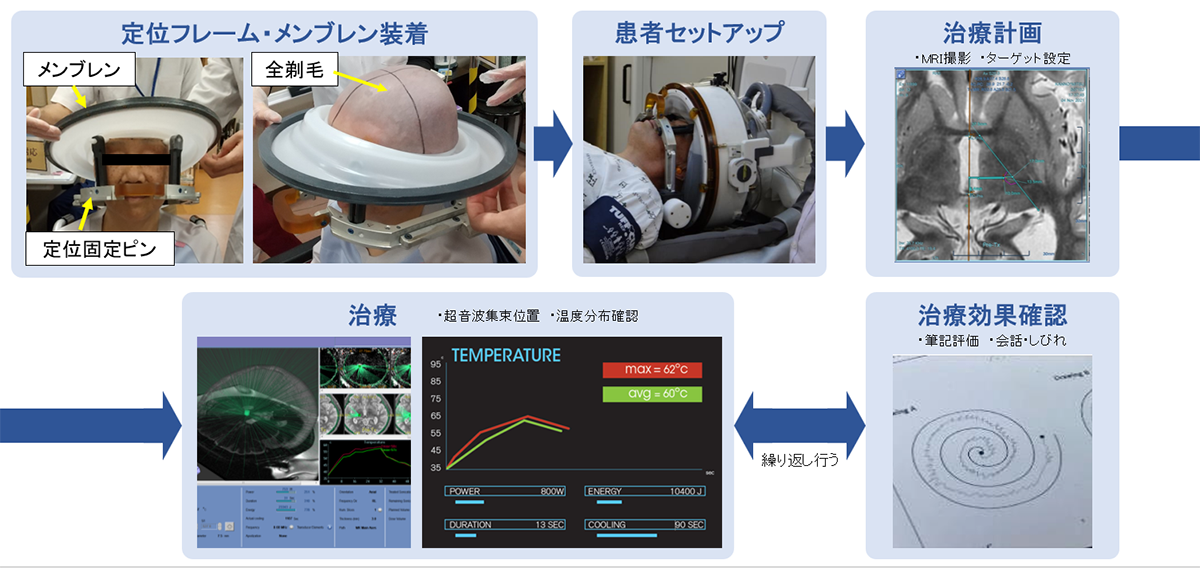
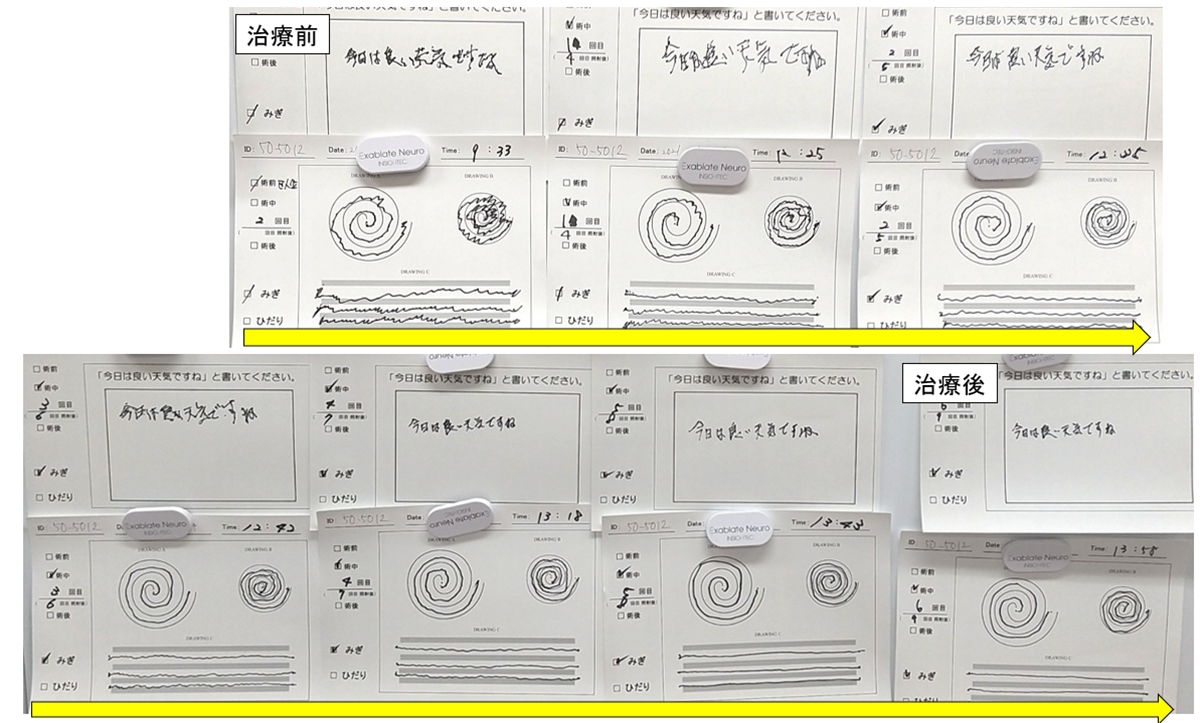
FUS治療中の振戦改善の様子
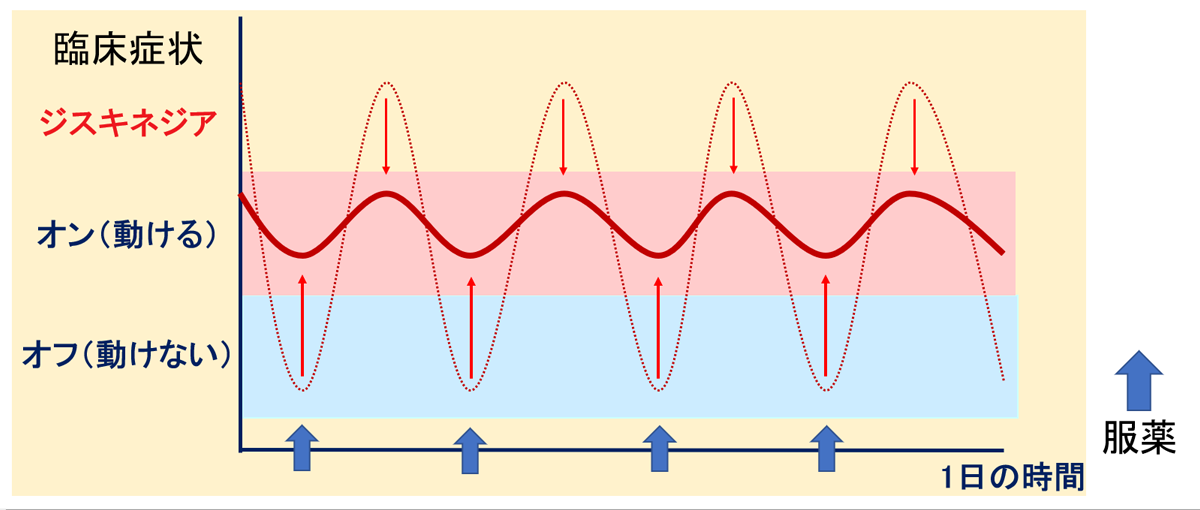
パーキンソン病の臨床症状
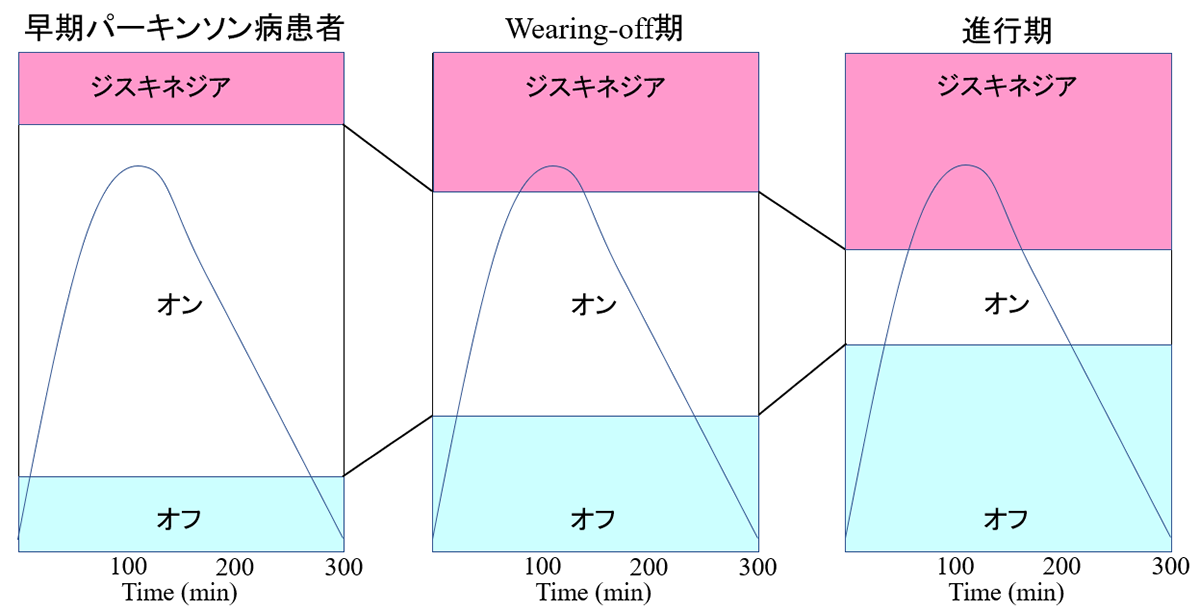
L-ドパ反応への変化
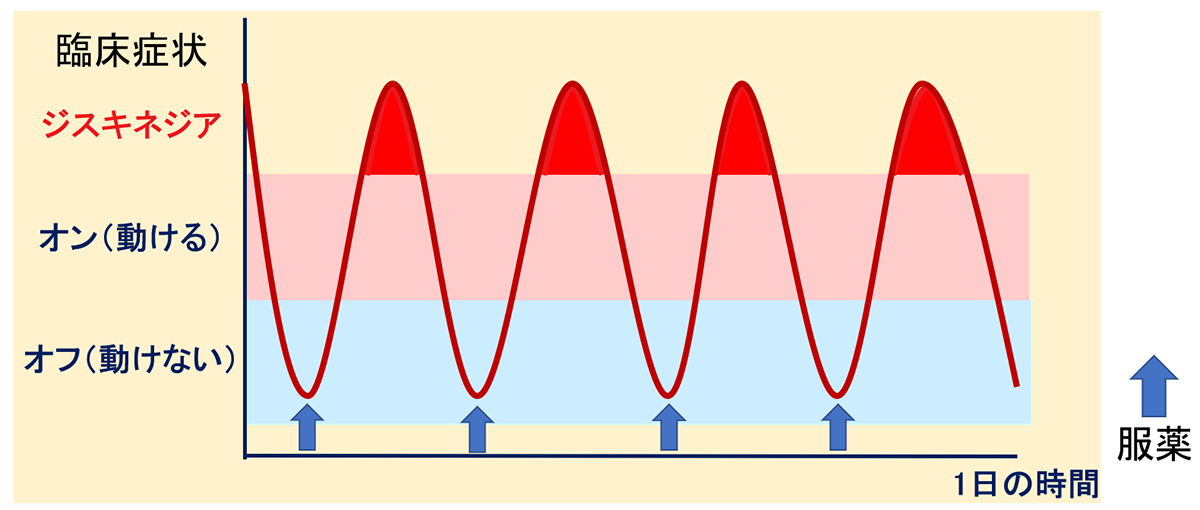
日内変動(wearing-off)とジスキネジア
L-dopa製剤は半減期の短い薬剤です。
長期内服すると、L-dopaの血中濃度の変化により症状の日内変動、不随意運動(ジスキネジア)が出現します。
手術後の変化
刺激による症状の改善(底上げ)が得られます。
減薬することによりジスキネジアの軽減が得られます。
パーキンソン病の外科的治療の適応
| 必要条件 |
|
|---|---|
| + | |
| いずれかの症状を認める |
|
手術のタイミングと臨床経過
DBSにより、術後しばらく症状安定期が得られます。
手術のタイミングにより得られるADLの改善度は異なります(赤の点線)。
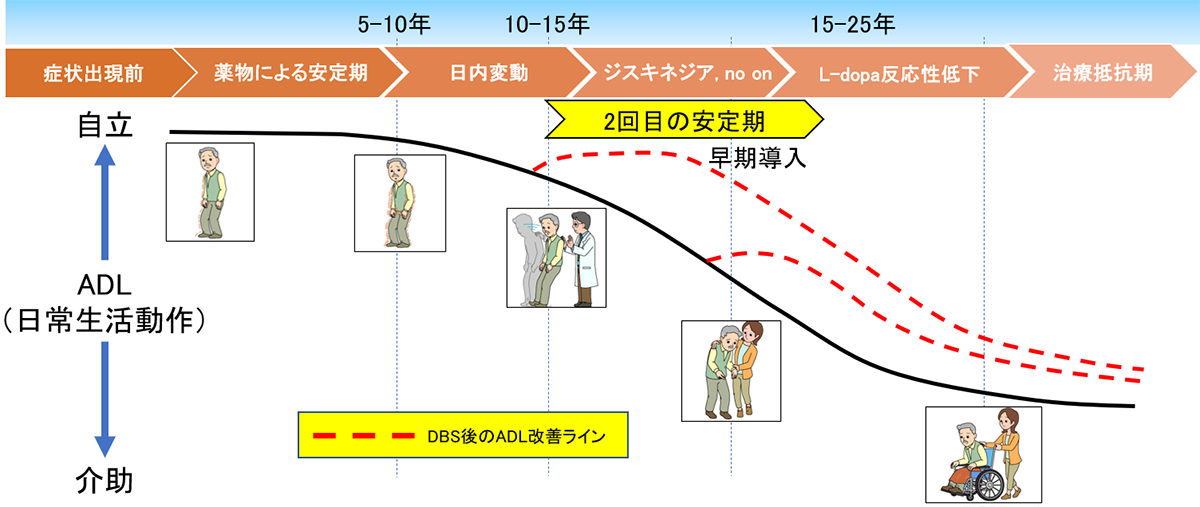
術後の刺激設定
 術後に行う刺激開始が本当の治療開始になります。
術後に行う刺激開始が本当の治療開始になります。- 設定項目:電流(電圧)、パルス幅、周波数を組み合わせて調節します。
- 左右別々に調節することが可能です。
パーキンソン病の患者さんは症状に左右差がある方がほとんどです。
DBSで左右のバランスをとることが可能です。 - 薬物療法と並行して行う必要があります。
SDGsの取り組み
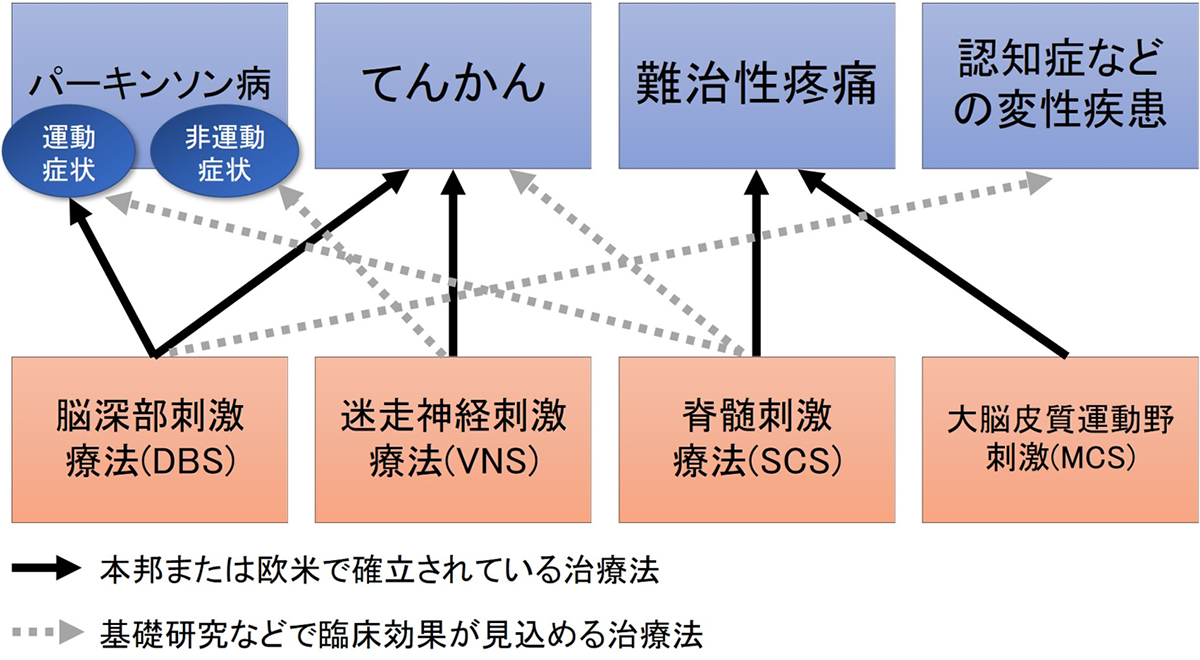
 ニューロモデュレーション治療が神経難病にもたらす光
ニューロモデュレーション治療が神経難病にもたらす光
岡山大学学術研究院医歯薬学域 教授 伊達 勲、助教 佐々木達也
社会的背景(神経難病とニューロモデュレーション治療
 てんかん、パーキンソン病、ジストニア、難治性疼痛などは、進行性・薬物抵抗性の場合、健康面ばかりではなく、社会生活でも大きな制約をうけます。ニューロモデュレーション治療(NM治療)とは脳、脊髄などに電極を留置し電気刺激により神経の調整を行う治療法であり、症状の改善やADL、QOLの向上に貢献します。
てんかん、パーキンソン病、ジストニア、難治性疼痛などは、進行性・薬物抵抗性の場合、健康面ばかりではなく、社会生活でも大きな制約をうけます。ニューロモデュレーション治療(NM治療)とは脳、脊髄などに電極を留置し電気刺激により神経の調整を行う治療法であり、症状の改善やADL、QOLの向上に貢献します。
活動の目的
- 一人一人の患者さんと向き合い、最適な治療を行う。
- NM治療に関わる質の高い基礎研究・臨床研究を行い社会に貢献する。
活動の概要
すでに十分効果が認められる治療については、症状を有する患者さんに対し、積極的に導入を検討します。
治療後も綿密な刺激調整を行い、ADL, QOLを維持できるように努めています。
NM治療は1対1の治療だけではなく、現在適応のない疾患に対しても有効性が報告されています。NM治療の礎となる基礎研究を行い、岡山大学発の臨床研究へとつなげたいと考えています。
期待される効果
- 基礎研究と臨床研究の架け橋
- NM治療を通じた医学ー産業の連携
- 疾患に対する職域を超えた包括的なチーム医療の実践
研究の特徴
本グループでは、脊椎脊髄グループと合同で、移植ステレオグループとして基礎研究を行っています。
臨床論文
2023
- Tsuchiya H, Shibata T, Sasaki T, Inoue T, Date I, Akiyama T, Kobayashi K. Effective Epilepsy Surgery for Post-Traumatic West Syndrome Following Abusive Head Trauma. Acta Med Okayama. 2023 Oct;77(5):561-566. doi: 10.18926/AMO/65980. PMID: 37899268.
2022
- Okazaki Y, Sasaki T, Kawai K, Hosomoto K, Sasada S, Yasuhara T, Akiyama T, Hanaoka Y, Date I. Two Cases of Monozygotic Twins with Early-onset Isolated (DYT1) Dystonia Effectively Treated with Bilateral Globus Pallidus Internus Stimulation. NMC Case Rep J. 2022 Sep 15;9:307-312. doi: 10.2176/jns-nmc.2022-0084. PMID: 36263189; PMCID: PMC9534566.
- Sasaki T, Yasuhara T, Date I. [Infections in Functional Neurosurgery:Focusing on Device-based Surgery]. No Shinkei Geka. 2022 Sep;50(5):1027-1034. Japanese. doi: 10.11477/mf.1436204662. PMID: 36128818.
- Hosomoto K, Sasaki T, Kawai K, Okazaki Y, Hyodo Y, Shibata T, Sasada S, Yasuhara T, Kobayashi K, Yanai H, Date I. A Case of a Solitary Cortical Tuber with No Other Manifestations of Tuberous Sclerosis Complex Mimicking Focal Cortical Dysplasia Type II with Calcification. Acta Med Okayama. 2022 Jun;76(3):323-328. doi: 10.18926/AMO/63742. PMID: 35790363.
- Sasaki T, Date I. [Essential Tremor That is Difficult to Improve with Standard Medical Treatment-Suppression: Surgical Treatment of Tremor]. Brain Nerve. 2022 May;74(5):645-651. Japanese. doi: 10.11477/mf.1416202092. PMID: 35589659.
2021
- Umakoshi M, Yasuhara T, Morimoto J, Murai S, Sasaki T, Kameda M, Kin K, Miyoshi Y, Date I. Spinal Surgery after Bilateral Subthalamic Stimulation for Patients with Parkinson’s Disease: A Retrospective Outcome Analysis of Pain and Functional Control. Neurol Med Chir (Tokyo). 2021 Oct 15;61(10):607-618. doi: 10.2176/nmc.oa.2021-0094. Epub 2021 Aug 18. PMID: 34408107; PMCID: PMC8531877.
- Sasaki T, Date I. [Programing of Deep Brain Stimulation and Features of Devices]. No Shinkei Geka. 2021 Jul;49(4):829-837. Japanese. doi: 10.11477/mf.1436204461. PMID: 34376615.
2019
- Sasaki T, Kuwahara K, Kin I, Okazaki M, Sasada S, Shinko A, Kameda M, Yasuhara T, Agari T, Date I. Identification of Somatotopic Organization and Optimal Stimulation Site Within the Subthalamic Nucleus for Parkinson’s Disease. Oper Neurosurg (Hagerstown). 2019 Sep 1;17(3):239-246. doi: 10.1093/ons/opy351. PMID: 30445556.
2018
- Sasaki T, Agari T, Date I. [Devices and Practices for Improving the Accuracy of Deep Brain Stimulation]. No Shinkei Geka. 2018 Sep;46(9):751-762. Japanese. doi: 10.11477/mf.1436203809. PMID: 30262679.
- Okazaki M, Sasaki T, Yasuhara T, Kameda M, Agari T, Kin I, Kuwahara K, Morimoto J, Kin K, Umakoshi M, Tomita Y, Borlongan CV, Date I. Characteristics and prognostic factors of Parkinson’s disease patients with abnormal postures subjected to subthalamic nucleus deep brain stimulation. Parkinsonism Relat Disord. 2018 Dec;57:44-49. doi: 10.1016/j.parkreldis.2018.07.014. Epub 2018 Jul 25. PMID: 30082148.
- Satoh T, Yagi T, Onoda K, Kameda M, Sasaki T, Ichikawa T, Date I. Hemodynamic features of offending vessels at neurovascular contact in patients with trigeminal neuralgia and hemifacial spasm. J Neurosurg. 2018 Jul 1:1-7. doi: 10.3171/2018.1.JNS172544. Epub ahead of print. PMID: 29979116.
- Sasaki T, Agari T, Kuwahara K, Kin I, Okazaki M, Sasada S, Shinko A, Kameda M, Yasuhara T, Date I. Efficacy of Dural Sealant System for Preventing Brain Shift and Improving Accuracy in Deep Brain Stimulation Surgery. Neurol Med Chir (Tokyo). 2018 May 15;58(5):199-205. doi: 10.2176/nmc.oa.2017-0242. Epub 2018 May 1. PMID: 29710057; PMCID: PMC5958041.
2017
- Kobayashi K, Akiyama T, Agari T, Sasaki T, Shibata T, Hanaoka Y, Akiyama M, Endoh F, Oka M, Date I. Significance of High-frequency Electrical Brain Activity. Acta Med Okayama. 2017 Jun;71(3):191-200. doi: 10.18926/AMO/55201. PMID: 28655938.
- Sasada S, Agari T, Sasaki T, Kondo A, Shinko A, Wakamori T, Okazaki M, Kin I, Kuwahara K, Kameda M, Yasuhara T, Date I. Efficacy of Fiber Tractography in the Stereotactic Surgery of the Thalamus for Patients with Essential Tremor. Neurol Med Chir (Tokyo). 2017 Aug 15;57(8):392-401. doi: 10.2176/nmc.oa.2016-0277. Epub 2017 May 1. PMID: 28458383; PMCID: PMC5566698.
2016
- Yasuhara T, Hishikawa T, Agari T, Kurozumi K, Ichikawa T, Kameda M, Shinko A, Ishida J, Hiramatsu M, Kobayashi M, Matsuoka Y, Sasaki T, Soga Y, Yamanaka R, Ashiwa T, Arioka A, Hashimoto Y, Misaki A, Ishihara Y, Sato M, Morimatsu H, Date I. Perioperative Management Center (PERIO) for Neurosurgical Patients. Neurol Med Chir (Tokyo). 2016 Sep 15;56(9):574-9. doi: 10.2176/nmc.oa.2016-0085. Epub 2016 Jul 11. PMID: 27396396; PMCID: PMC5027240.
2015
- Sasaki T, Manabe H, Yasuhara T, Miyoshi Y, Sugiu K, Date I. [Cervical spinal dural arteriovenous fistula with rapidly progressive brainstem dysfunction due to venous congestion: a case report]. No Shinkei Geka. 2015 Jan;43(1):51-6. Japanese. doi: 10.11477/mf.1436202944. PMID: 25557099.
2014
- Wakamori T, Agari T, Yasuhara T, Kameda M, Kondo A, Shinko A, Sasada S, Sasaki T, Furuta T, Date I. Cognitive functions in Parkinson’s disease: relation to disease severity and hallucination. Parkinsonism Relat Disord. 2014 Apr;20(4):415-20. doi: 10.1016/j.parkreldis.2014.01.002. Epub 2014 Jan 13. PMID: 24467818.
2013
- Yasuhara T, Agari T, Kameda M, Kondo A, Kuramoto S, Jing M, Sasaki T, Toyoshima A, Sasada S, Sato K, Shinko A, Wakamori T, Okuma Y, Miyoshi Y, Tajiri N, Borlongan CV, Date I. Regenerative medicine for epilepsy: from basic research to clinical application. Int J Mol Sci. 2013 Nov 28;14(12):23390-401. doi: 10.3390/ijms141223390. PMID: 24287913; PMCID: PMC3876052.
